고든정10mg 의 효능, 성분, 부작용, 복용법, 주의사항 등에 대해서 자세히 알아보도록 하겠습니다.
고든정10mg (Godn Tab. 10mg) 이란?
고든정10mg 이란, 평활근을 이완시켜 음경해면체내로의 혈액 유입을 증가시킴으로써 발기를 촉진시키는약입니다.
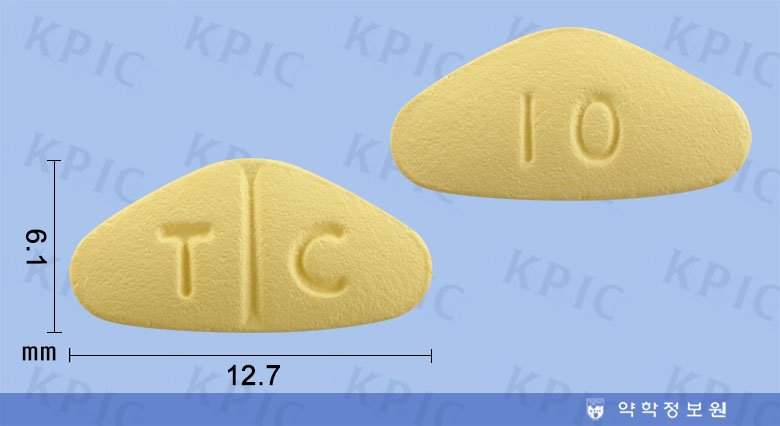
고든정10mg의 앞 뒤에는 식별자인 T C / 10가 새겨져 있는데요.
C / 10가 새겨져 있는데요.
크기는 장축 12.7mm / 단축 6.1mm / 두께 3.2mm인 분할선을 가진 노란색의 모서리가 둥근 삼각형 모양의 필름코팅정제 입니다.
고든정10mg 제품 기본정보
고든정10mg의 제품 기본정보는 다음과 같습니다.
| 제품명 | 고든정10mg Godn Tab. 10mg | ||
| 제조 / 수입사 |
(주)씨티씨바이오 | ||
| 성분 / 함량 |
Tadalafil 타다라필 10mg | ||
| 첨가제 | D-만니톨 라우릴황산나트륨 미결정셀룰로오스 |
||
| 도핑금지 약물정보 |
경기기간중:허용 경기기간외:허용 ※ 상세정보는 한국도핑방지위원회 홈페이지를 통해 확인바랍니다. |
||
| 전문 / 일반 |
전문(오남용의약품) | 단일 / 복합 |
단일 |
| 대조 / 생동 |
허가일 | 2019년 05월 21일 |
|
| 제형 | 정제 | 투여 경로 |
경구(내용고형) |
| 성상 | 분할선을 가진 노란색의 모서리가 둥근 삼각형 모양의 필름코팅정제 | ||
| 저장방법 | 기밀용기, 실온보관(1-30℃) | ||
| 포장단위 (식약처 기준) |
8정(8정/PTP × 1) | ||
| 급여정보 | |||
| ATC 코드 |
G04BE08 : TADALAFIL | ||
| 식약처 분류 |
기타의 비뇨생식기관 및 항문용약 (259) | ||
| KPIC 약효분류 |
|
||
| KPIC 학술 |
|
||
| 대한 약사저널 |
|
||
| 제품 설명서 |
확인하기( 2019-07-24 게시 ) | ||
고든정10mg의 효능 및 효과
발기부전 (erectile dysfunction)의 치료
본 품목이 효과적이려면, 성적자극(sexual stimulation)을 필요로 한다. 본 품목은 여성에 의한 사용을 그 적응증으로 하지 않는다.
고든정10mg 복용법
경구 투여용.
성인 남성에서의 사용
이 약의 권장 용량은 10mg이며, 예상되는 성 행위 전에 식사에 상관없이 복용한다.
타다라필 (tadalafil) 10mg이 충분한 효과를 나타내지 않는 환자들에게는 20 mg을 시도하여도 좋다. 이 약은 적어도 성 행위 30 분 전부터 투여할 수 있다
최대 권장 복용 빈도는 1일 1회이다.
연장된 매일 투약 후에 대한 장기간 안전성이 확립되지 않았고, 또한 이 약의 효과가 보통 하루 이상 지속되기 때문에 이 약제를 지속적으로 매일 투여하는 것은 강하게 권장되지 않는다. [1.경고 항 및 12.1) 약력학적 특성 항 참조]
고령 남성에서의 사용
고령 환자에서 용량 조절 (dosage adjustments)을 필요로 하지 않는다.
신기능 장애가 있는 남성에서의 사용
경증 내지 중등도의 신장애가 있는 환자에서 용량조절을 필요로 하지 않는다. 심한 신장애 환자에서 최대 권장용량은 10mg이다. [12.2) 약동학적 특성 항 참조].
간 기능 장애가 있는 남성에서의 사용
본 품목의 권장 용량은 10mg이며, 예상되는 성 행위 전에 식사에 상관없이 복용한다. 중증 간기능부전 환자(Child-Pugh Class C)에서 본 품목의 안전성에 대한 임상자료는 제한적이므로 처방하는 경우, 의사는 신중하게 개개의 이익/위험(benefit/risk) 을 평가하여야 한다. 간 장애 (hepatic impairment) 환자들에게 10mg 보다 고용량을 투여한 자료가 없다. [3.다음 환자에는 신중히 투여할 것 항 및 12.2) 약동학적 특성 항 참조].
당뇨병이 있는 남성에서의 사용
당뇨병 환자에서 용량 조절을 필요로 하지 않는다.
소아 및 청소년에서의 사용
본 품목은 18세 미만의 사람에게 사용해서는 안 된다.
고든정10mg 복약 정보
- 과량투여시 심각한 부작용이 나타날 수 있으므로 반드시 정해진 용법·용량을 지켜주세요.
- 투여초기나 증량 시 안면홍조, 두통 등의 증상이 일시적으로 나타날 수 있어요.
- 혈압약을 복용 중인 환자는 전문가에게 미리 알리세요.
- 심혈관계 질환이 있는 경우 전문가에게 미리 알리세요.
- 발기현상이 4시간 이상 지속되면 의사에게 알리세요.
고든정10mg 부작용 및 주의사항
1. 경고
1) 이 약을 투여하고자 하는 환자는 약리학적인 요법을 고려하기 전에, 발기 부전을 진단하고 잠재적으로 근원적인 원인을 측정하기 위하여 의학 병력(medical history)과 신체검사(physical examination)를 실시하여야 한다.
2) 성 행위로 수반되는 심장에 대한 위험성이 있기 때문에, 발기 부전에 대한 치료를 시작하기 전에, 의사는 환자의 심혈관 상태를 고려하여야 한다. 성행위를 시작한 후 심혈관계 질환과 관련된 증상을 경험한 환자는 더 이상의 성행위를 삼가고, 이를 의사에게 알려야 한다.
3) 이 계열의 약물에서 4시간 이상의 지속된 발기 및 지속발기증(6시간 이상의 통증을 수반한 발기)이 드물게 보고되었다. 4시간 이상 발기가 지속될 경우 즉시 의사의 도움(medical assistance)을 구하라고 환자에게 알려주어야 하며, 지속발기증을 즉시 치료하지 않을 경우 음경 조직의 손상 및 발기력의 영구상실을 초래할 수 있다.
4) 이 약을 투여하기 전이나 투여하는 동안 및 투여한 후 모든 형태의 질산염 제제 또는 NO 공여제(니트로글리세린, 아밀나이트레이트, 질산이소소르비드)를 복용하는 경우 혈압강하 작용이 증강되어 과도하게 혈압이 떨어질 수 있으므로 의사는 이 약을 처방하기 전에 환자가 질산염 제제 및 NO 공여제를 투여하지 않았는지 충분히 확인하여야 하며, 이 약 투여 중 및 투여 후 질산염 제제 및 NO 공여제를 투여하지 않도록 주의시킨다.
5) 심근경색, 급성 심정지, 불안정한 협심증(unstable angina pectoris), 심실 부정맥(ventricular arrhythmia), 뇌졸중, 및 일과성 허혈성 발작(transient ischemic attacks), 흉통, 심계항진, 빈맥을 포함한 중대한 심혈관계 유해사례(cardiovascular events)가 이 약의 임상연구 및/또는 시판 후 조사 중에 발생하였다. 또한 임상시험에서 고혈압과 저혈압(체위성 저혈압 포함)도 드물게 나타났다. 이러한 유해사례들이 나타난 환자들의 대부분은 이전부터 심혈관계 위험인자들(pre-existing cardiovascular risk factors)을 가지고 있었다. 그러나, 이러한 유해사례들이 심혈관계 위험인자들 또는 이 약 또는 성 행위 또는 이러한 인자들의 조합 또는 다른 인자 등과 직접적인 연관이 있는지는 분명히 밝혀지지 않았다.
6) 타다라필을 6~12개월간 매일 25mg/kg/일(20mg의 단회 용량을 투여한 인체에서 관찰된 노출보다 최소한 3배를 넘는 노출[범위 3.7~18.6] 결과 초래) 및 그 이상의 용량으로 개에 투여했을 때, 일부 개에서 정자형성(spermatogenesis)의 감소를 가져오는 정세관상피(seminiferous tubular epithelium)의 퇴행(regression)이 있었다.
이 약의 정자형성(spermatogenesis)에 대한 잠재적인 영향을 평가하기 위해, 본 약물 10mg을 6개월 간 매일 복용하거나, 20mg을 각각 6개월 또는 9개월간 매일 복용한 남성들에서 3가지 임상연구들이 실시되었다. 이 중 2개의 연구에서 타다라필의 치료와 관련하여 임상적 타당성은 없어 보이는 정자 숫자와 농도의 감소가 관찰되었다. 정자 운동성, 형태, 난포자극호르몬(follicle stimulating hormone) 의 다른 척도들의 변화는 관찰되지 않았다[11. 1) 약력학적 특성 항 참조].
7) 좌심실유출폐색(예 : 대동맥 협착증 및 특발성 비후성 대동맥판 하부 협착증)이 있는 환자는 PDE5 저해제를 포함한 혈관확장제의 작용에 민감할 수 있다.
2. 다음 환자에는 투여하지 말 것
1) 어떠한 형태의 유기 질산염(organic nitrate) 제제라도 정기적 및/또는 간헐적으로 복용하는 환자에게는 이 약의 투여가 금기이다[1. 경고 및 6. 상호작용항 참조]. 임상시험에서 타다라필(tadalafil)은 질산염(nitrate)의 저혈압 작용을 증가시키는 것으로 나타났다. 타다라필은 혈관확장 성질을 가지므로, 일시적으로 혈압을 약간 감소시키며[11. 1) 약력학적 특성 항 참조] 그 결과 질산염의 혈압저하 작용을 증가시킨다. 이것은 질소산화물(nitric oxide)/cGMP 경로에 대한 질산염과 타다라필의 복합 효과의 결과로 판단된다.
2) 이 약을 포함한 발기 부전(erectile dysfunction)을 치료하는 약물들은 성 행위가 권장되지 않는 심장 질환(cardiac disease)이 있는 남성에게 사용해서는 안 된다. 의사는 이전부터 심혈관계 질환이 있는 환자에서 성 행위로 인한 잠재적인 심장 위험(cardiac risk)을 고려하여야 한다.
3) 심혈관계 질환이 있는 다음의 환자군은 임상 시험에 포함되지 않았으므로 이 약의 사용이 금기이다. :
– 최근 90일 이내에 심근경색(myocardial infarction)이 있었던 환자
– 불안정한 협심증(unstable angina) 또는 성교(sexual intercourse) 중에 발생한 협심증(angina)이 있었던 환자
– 최근 6개월 동안 New York Heart Association Class 2 또는 그 이상의 심부전(heart failure)이 있었던 환자
– 조절되지 않는(uncontrolled) 부정맥(arrhythmias), 저혈압(〈90/50mmHg), 또는 조절되지 않는 고혈압(〉170/100mmHg) 환자
– 최근 6개월 이내에 뇌졸중(stroke)이 있었던 환자
4) 색소성 망막염을 포함하여 이미 알려진 유전적인 퇴행성 망막질환자는 임상 시험에 포함되지 않았으므로 이 약의 사용이 권장되지 않는다.
5) 이 약은 타다라필이나 이 약의 성분에 과민증(hypersensitivity)이 있는 환자에게 투여하면 안 된다.
6) 이 약과 다른 발기부전 치료 요법의 병용에 대한 안전성과 유효성이 연구되지 않았으므로 다른 발기부전 치료제와의 병용 투여는 권장되지 않는다.
7) 이 약은 유당을 함유하고 있으므로, 갈락토오스 불내성(galactose intolerance), Lapp 유당분해효소 결핍증(Lapp lactase deficiency) 또는 포도당-갈락토오스 흡수장애(glucose-galactose malabsorption) 등의 유전적인 문제가 있는 환자에게는 투여하면 안 된다.
8) 이전의 PDE5 저해제 복용 여부와 관계없이 비동맥전방허혈성시신경증(Non-arteritic anterior ischemic optic neuropathy, NAION)으로 인해 한쪽 눈의 시력이 손실된 환자에게는 이 약을 투여하면 안 된다.
9) 이 약을 포함한 PDE5저해제와 GC 자극제(Guanylate Cyclase Stimulator)(예: 리오시구앗)를 병용 투여 하는 경우, GC 자극제(Guanylate Cyclase Stimulator)의 혈압강하효과를 증가 시킬 수 있으므로, 두 약물의 병용투여는 금기이다.
3. 다음 환자에는 신중히 투여할 것
1) 음경이 해부학적으로 기형인 환자(각형성(angulation), 해면 섬유증(cavernosal fibrosis) 또는 Peyronies disease) 또는 음경강직증의 소인이 될 조건을 가진 환자(겸상적혈구빈혈(sickle cell anemia), 다발성골수종(multiple myeloma) 또는 백혈병)에게는 이 약을 포함한 발기부전치료제를 신중히 투여하여야 한다.
2) 증가된 타다라필 노출(AUC)과 제한적인 임상자료, 투석에 의한 클리어런스 능력부족으로 이 약 1일 1회 용법은 심한 신장애를 지닌 환자에게는 권장되지 않는다.
3) 중증 간기능부전 환자(Child-Pugh Class C)에서 이 약의 안전성에 대한 임상자료는 제한적이므로 의사는 신중하게 개개의 유익성/위험성(benefit/risk)을 평가하여야 하며, 경증 내지 중등증의 간기능 장애 환자에서는 이 약의 용량은 10mg을 초과해서는 안 된다.
간 장애가 있는 환자들에게 타다라필 1일 1회 투여 용량에 대한 이용 가능한 자료가 없으므로 처방하는 경우, 의사는 신중하게 개개의 유익성/위험성(benefit/risk) 을 평가하여야 한다.
4) 독사조신(doxazosin)과 같은 알파(1) 차단제(alpha(1) blockers)를 복용하는 환자에게 이 약을 병용투여하면 일부 환자에서는 저혈압 증상이 나타날 수 있다[6.상호작용 항 참조]. 따라서 타다라필과 알파차단제(alpha blockers)와의 병용은 권장되지 않는다.
5) 강력한 CYP3A4 저해제(ritonavir, saquinavir, ketoconazole, itraconazole, erythromycin)를 복용하는 환자에게 이 약을 병용투여시 타다라필의 노출(AUC)의 증가가 관찰되었으므로 주의하여야 한다[6. 상호작용 항 참조]. 이 약과 강력한 CYP3A4 저해제를 병용투여 할 경우에는 이 약의 투여용량을 최고 10mg을 초과하지 않도록 하며, 이 약 투여 후 72시간 내에 재투여하여서는 안 된다.
6) 발기부전의 평가는 잠재적으로 내재한 원인(potential underlying cause) 결정과 적절한 의료평가에 뒤이은 적절한 치료법의 확인을 포함하여야 한다. 이 약이 비신경보전 근치전립선적출술(radical non-nerve-sparing prostatectomy)를 받은 환자에서 효과적인지 여부가 알려져 있지 않다.
4. 이상반응
1) 임상 시험 경험
임상 시험은 다양한 조건에서 실시되므로, 한 약물의 임상시험에서 관찰되는 이상반응 발생율을 다른 약물에 대한 임상시험에서의 발생율과 직접 비교할 수 없고, 실제 임상에서 관찰되는 비율을 반영하지 못할 수도 있다.
타다라필은 전세계적으로 실시한 임상 시험에서 9,000명 이상의 남성에게 투여되었다. 1일 1회 용법에 대한 이 약의 임상시험에서, 총 1434, 905, 115명이 각각 최소 6개월, 1년, 2년동안 투여를 받았다. 필요 시 복용하는 용법에 대해서는, 1300명 및 1000명 이상이 각각 적어도 6개월 및 1년 동안 투여를 받았다.
발기부전에 대한 필요시 복용요법
12주동안 실시된 8건의 주요 위약 대조 임상 시험에서, 이 약을 투여 받은 환자의 평균 연령은 59세였고(22-88세), 이 약 10 또는 20mg을 투여한 환자에서 이상반응으로 인한 중단률은 3.1%인 반면, 위약군에서는 1.4%였다.
위약 대조 임상 시험에서 권장된 바에 따라 필요시 복용하는 용법으로 이 약을 투여하였을 때, 다음의 이상 반응이 보고되었다(표 1).
표 1: 발기부전에 대해 필요 시 복용요법에 대한 8건의 주요 위약 대조 임상시험에서(당뇨 환자에 대한 시험 포함) 이 약(10 또는 20mg)을 투여받은 환자의 2% 이상에서 보고되고, 위약에 비해 약물 투여군에서 더 빈번하게 보고된 약물치료 관련 이상반응
|
이상반응 |
위약(N=476) |
타다라필 5mg (N=151) |
타다라필 10mg (N=394) |
타다라필 20mg (N=635) |
|
두통 |
5% |
11% |
11% |
15% |
|
소화불량 |
1% |
4% |
8% |
10% |
|
요통 |
3% |
3% |
5% |
6% |
|
근육통 |
1% |
1% |
4% |
3% |
|
비충혈 |
1% |
2% |
3% |
3% |
|
홍조* |
1% |
2% |
3% |
3% |
|
팔다리 통증 |
1% |
1% |
3% |
3% |
*홍조의 용어는 안면홍조 및 홍조를 포함.
발기부전에 대한 1일 1회 용법
12 또는 24주 동안 실시된 3건의 위약 대조 임상 시험에서, 이 약을 투여받은 환자의 평균 연령은 58세였고(21-82세), 이 약을 투여받은 환자에서 이상반응으로 인한 중단율은 4.1%인 반면, 위약을 투여받은 환자에서는 2.8%였다.
12주 동안 실시된 임상 시험들에서 다음의 이상반응들이 보고되었다(표 2 참고).
표 2: 발기부전에 대해 이 약을 1일 1회 용법으로 12주 동안 투여한 3건의 주요 위약 대조 제 3상 임상 시험에서(당뇨 환자에 대한 시험 포함) 이 약 1일 1회(2.5 또는 5mg) 투여받은 환자의 2% 이상에서 보고되고, 위약에 비해 약물 투여군에서 더 빈번하게 보고된 약물치료 관련 이상반응
|
이상반응 |
위약(N=248) |
타다라필 2.5mg (N=196) |
타다라필 5mg (N=304) |
|
두통 |
5% |
3% |
6% |
|
소화불량 |
2% |
4% |
5% |
|
비인두염 |
4% |
4% |
3% |
|
요통 |
1% |
3% |
3% |
|
상기도 감염 |
1% |
3% |
3% |
|
홍조 |
1% |
1% |
3% |
|
근육통 |
1% |
2% |
2% |
|
기침 |
0% |
4% |
2% |
|
설사 |
0% |
1% |
2% |
|
비충혈 |
0% |
2% |
2% |
|
팔다리 통증 |
0% |
1% |
2% |
|
요로 감염 |
0% |
2% |
0% |
|
위식도 역류성 질환 |
0% |
2% |
1% |
|
복통 |
0% |
2% |
1% |
다음 이상반응은 1건의 위약 대조 임상 시험에서 24주에 걸쳐 보고된 것이다(표 3 참고)
표 3: 발기부전에 대해 이 약을 1일 1회 용법으로 24주 동안 투여한 1개의 위약 대조 임상시험에서 이 약 1일 1회 사용(2.5 또는 5mg)을 투여받은 환자의 2% 이상에서 보고되고, 위약에 비해 약물 투여군에서 더 빈번하게 보고된 약물치료 관련 이상반응
|
이상반응 |
위약 (N=94) |
타다라필 2.5mg (N=96) |
타다라필 5mg (N=97) |
|
비인두염 |
5% |
6% |
6% |
|
위장염 |
2% |
3% |
5% |
|
요통 |
3% |
5% |
2% |
|
상기도 감염 |
0% |
3% |
4% |
|
소화불량 |
1% |
4% |
1% |
|
위식도역류성 질환 |
0% |
3% |
2% |
|
근육통 |
2% |
4% |
1% |
|
고혈압 |
0% |
1% |
3% |
|
비충혈 |
0% |
0% |
4% |
양성 전립선 비대증과 양성전립선비대증 및 발기부전을 동반한 환자에 대한 1일 1회 용법
12주 기간의, 3건의 위약-대조 제 3상 임상시험(이 중 2건은 양성전립선 비대증 환자, 나머지 1건은 양성전립선비대증 및 발기부전을 동반한 환자)에서, 이 약을 투여받은 환자의 평균 연령은 63세 (44-93세)였고 이상반응으로 인한 중단율은 3.6%인 반면, 위약 투여 환자에서는 1.6%였다. 적어도 이 약을 투여받은 2명의 환자에 의해 보고된 치료중단을 유발한 이상반응으로는 두통, 상복부 통증, 근육통이다. 다음의 이상반응이 보고되었다(표 4 참고).
표4: 양성 전립선 비대증에서 1일 1회 용법의 이 약의 12주 치료 기간의, 3건의 위약-대조 임상 시험에서 1일 1회 용법의 5 mg 치료 환자의 ≥1%에서 보고되고 위약 보다 높은 빈도로 나타난 약물치료 관련 이상반응 (2개의 양성 전립선 비대증 임상과 1개의 양성 전립선 비대증 및 발기부전에 대한 임상 포함)
|
이상반응 |
위약 (N=576) |
타다라필 5 mg (N=581) |
|
두통 |
2.3% |
4.1% |
|
소화불량 |
0.2% |
2.4% |
|
요통 |
1.4% |
2.4% |
|
비인두염 |
1.6% |
2.1% |
|
설사 |
1.0% |
1.4% |
|
팔다리 통증 |
0.0% |
1.4% |
|
근육통 |
0.3% |
1.2% |
|
어지러움 |
0.5% |
1.0% |
추가적으로, 양성 전립선 비대증과 발기부전 및 양성 전립선 비대증 대조 임상시험에서 덜 빈번한 이상반응(<1%)으로는 위식도 역류, 상복부 통증, 오심, 구토, 관절통, 근육연축(muscle spasm)이 있다.
요통 또는 근육통은 표 1부터 4까지 기재된 빈도로 보고되었다. 이 약의 임상 약리 시험에서, 요통 또는 근육통은 일반적으로 투여 후 12-24시간 후에 발생하였고, 일반적으로 48시간 이내에 소실되었다. 이 약 투여와 관련된 요통/근육통은 확산 양측 하부 허리, 둔부, 대퇴 또는 등허리 근육 불편의 특징을 나타내며, 횡와위(옆으로 누움)에 의해 악화되었다. 일반적으로, 통증은 경증 또는 중등증으로 보고되었고, 의학적 치료 없이 소실되었으나, 중증의 요통은 낮은 빈도로 보고되었다(모든 보고의 <5%). 의학적 치료가 필요할 때, 아세트아미노펜 또는 비스테로이드성 소염제가 일반적으로 효과적이지만, 치료를 요하는 피험자의 일부에서, 경도의 마약성(예. 코데인) 진통제가 사용되었다. 전반적으로, 필요 시 용법으로 이 약을 투여한 모든 피험자의 약 0.5%가 요통/근육통의 결과로 투여를 중단하였다. 1년간 공개 연장 시험에서, 요통과 근육통은 환자의 각각 5.5%와 1.3%에서 보고되었다. 염증, 근육 손상 또는 신손상에 대한 평가를 포함한 진단적 검사 결과, 의학적으로 유의한 기존 병인의 증거는 없었다. 발기부전, 양성 전립선 비대증, 양성 전립선 비대증/발기부전에 대한 이 약의 1일 1회 용법에서 발생률은 표 2, 3, 4에 서술하였다. 이 약 1일 1회 사용에 대한 시험에서, 요통과 근육통의 이상반응은 일반적으로 경증 또는 중등증 이었고, 모든 적응증에서 중단율은 <1%였다.
이 약을 투여한 모든 시험들에서 색각 변화의 빈도는 드물었다(환자의 <0.1%).
발기부전에 필요 시 복용요법에 대한 위약-대조 임상시험들에서, 이 약을 투여 받은 65세 이상의 환자들에게서 설사가 더욱 빈번하게 보고되었다. (2.5%)
다음은 1일 1회 용법 또는 필요 시 용법으로 복용한 이 약의 대조 임상 시험에서 보고된 추가적인, 덜 빈번한 이상반응(<2%)을 나타낸 것이다. 이러한 이상반응들과 이 약의 인과적 관련성은 확실하지 않다. 이 목록에서 제외된 것은 경미하고, 약물 사용과 관련 가능성이 없으며 정확하지 않아서 의미가 없는 사례들이다.
– 전신 : 근무력, 안면부종, 피로, 통증, 말초 부종
– 심혈관계 : 협심증, 흉통, 저혈압, 심근경색, 기립성 저혈압, 심계항진, 실신, 빈맥
– 소화기계 : 간기능 검사 수치 비정상, 구내건조, 연하곤란, 식도염, 위염, GGTP 증가, 묽은 변, 오심, 상복부 통증, 구토, 위식도 역류, 치질성 출혈, 직장출혈
– 근골격계 : 관절통, 목 통증
– 신경계 : 어지러움, 감각저하, 불면증, 이상감각, 졸음, 현기증
– 신장 및 비뇨기계 : 신장애
– 호흡기계 : 호흡곤란, 비출혈, 인두염
– 피부 : 가려움, 발진, 발한
– 안과 : 시야 흐림, 색각이상, 결막염(결막 충혈 포함), 눈 통증, 눈물 분비 증가, 눈꺼풀 부종
– 청각 : 갑작스러운 청력 감소 또는 상실, 이명
– 비뇨생식기계 : 발기 증가, 자발적 음경 발기
2) 해외 시판 후 사용 경험
다음 이상반응은 이 약의 승인 후 사용 기간 중 확인되었다. 이러한 반응들은 불특정 크기의 모집단으로부터 자발적으로 보고되었으므로, 항상 약물 노출과의 인과적 관련성을 확립하거나, 이들의 빈도를 신뢰적으로 평가할 수 있는 것은 아니다. 이러한 이상반응들은 중대성, 보고 빈도, 명백한 다른 원인이 없음 또는 이들 인자들의 복합적 요소로 인해 포함되었다.
심혈관계 및 뇌혈관계- 이 약의 사용과 일시적으로 관련이 있는 것으로는 심근경색, 심장 돌연사, 뇌졸중, 흉통, 심계항진, 심실 부정맥 및 빈맥을 포함한 중대한 심혈관계 이상반응이 시판 후 보고되었다. 이들 환자들은 모두는 아니지만 대부분 기존에 심혈관계 위험 인자가 있었다. 이러한 이상반응 중 대부분은 성행위 중 또는 직후에 발생한 것으로 보고되었고, 일부는 성 행위 없이, 이 약 사용 직후에 발생한 것으로 보고되었다. 다른 이상반응들은 이 약 사용 및 성행위 후 수시간 내지 수일 후에 발생한 것으로 보고되었다. 이러한 이상반응들이 이 약, 성행위, 환자의 기존 심혈관계 질환과 직접적으로 관련이 있는지, 이러한 인자들의 복합적 요소들과 관련이 있는지 또는 다른 인자들과 관련이 있는지 여부는 확인할 수 없다 (1. 경고 항 참조)
전신- 두드러기, 스티븐-존슨 증후군, 표피 박리성 피부염을 포함한 과민 반응
신경계- 편두통, 발작 및 발작의 재발, 일과성전체기억상실증
안과- 시야 결손, 망막 정맥 폐쇄, 망막 동맥 폐쇄, 영구적 시력 상실을 포함한 시력 감소의 원인이 되는 비동맥전방허혈성시신경증 (Non-arteritic anterior ischemic optic neuropathy [NAION])이 이 약을 포함한 PDE5 저해제의 사용과 시기적으로 관련하여 시판 후 드물게 보고되었다. 이러한 환자들은 모두는 아니지만 대부분이 기존에 다음을 포함한(반드시 이에 한정되지는 않음) NAION의 발현에 대한 해부학적 위험인자 또는 혈관 위험 인자를 가지고 있었다: 낮은 유두함몰 비율(low cup/ disc ratio, crowded disc), 50세 이상, 당뇨병, 고혈압, 관상 동맥 질환, 고지혈증, 흡연.(5. 일반적 주의 항 참조)
청각― 시판 후 이 약을 포함한 PDE5 저해제의 사용과 시기적으로 연관성이 있는 것으로 갑작스러운 청각 상실 또는 감소의 증례가 보고되었다. 일부 증례에서, 청각 이상반응에 중요한 역할을 할 수 있는 의학적 상태 및 기타 인자들이 보고되었다. 많은 증례에서, 의학적 추적관찰 정보는 제한적이었다. 이렇게 보고된 이상반응이 이 약의 사용과 직접적으로 관련이 있는지, 환자의 청각 상실에 대한 기존 위험 인자와 관련이 있는지, 이러한 인자들의 복합적 요소에 의한 것인지, 다른 인자에 의한 것인지 여부는 확인할 수 없다 (5. 일반적 주의 항 참조)
비뇨생식기계― 지속발기증(1. 경고 항 참조)
면역계 – 혈관부종
3) 이 약 1일 1회 투여시 심전도 이상와 일차성 동서맥(Primarily sinus bradycardia)이 위약군보다 약간 높게 발현되었다. 대부분의 심전도 이상은 이상반응과 무관하였다.
4) 국내 시판 후 조사결과
① 타다라필 5mg 단일제의 시판 후 조사결과
● 국내에서 재심사를 위하여 4년 동안 613명의 발기부전 환자를 대상으로 실시한 시판 후 조사 결과, 유해사례 발현율은 약과의 인과관계에 상관없이 4.73%(29명/613명, 37건)로 나타났으며, 이 중 이 약과의 인과관계를 배제할 수 없는 약물유해반응 발현율은 3.75%(23명/613명, 31건) 이었다.
– 약물유해반응은 두통 1.14%(7명/613명)[7건], 근육통 0.82%(5명/613명)[5건], 홍조 0.65%(4명/613명)[4건], 안면홍조 0.49%(3명/613명)[3건], 가려움, 비충혈 각 0.33%(2명/613명)[2건], 이상감각, 시각장애, 심계항진, 소화불량, 안면부종 각 0.16%(1명/613명)[1건]으로 조사되었다.
– 중대한 약물유해반응은 없었다.
– 예상하지 못한 약물유해반응은 시각장애 0.16%(1명/613명)[1건]으로 보고되었다.
② 타다라필 10mg, 20mg 단일제의 시판 후 조사결과
● 국내에서 재심사를 위하여 6년 동안 10,500명의 환자를 대상으로 실시한 시판 후 조사 결과, 유해사례 발현율은 약과의 인과관계에 상관없이 3.94%(414명/10,500명, 517건)로 나타났으며, 이 중 이 약과의 인과관계를 배제할 수 없는 약물유해반응 발현율은 3.47% (364명/10,500명, 461건) 이었다.
– 약물유해반응은 두통, 안면홍조가 각 1.30%(136명/10,500명, 136건)로 가장 많았으며, 소화불량 0.33% (35명/10,500명, 35건), 근육통 0.19% (20명/10,500명, 21건), 비충혈 0.12% (13명/10,500명, 13건), 어지럼증 0.11% (12명/10,500명, 12건), 배통 0.07% (7명/10,500명, 7건), 지속발기증 0.06%(6명/10,500명, 6건), 혈액요소질소증가 0.06%(6명/10,500명, 6건), 빈맥 0.05% (5명/10,500명, 5건), 심계항진 0.04%(4명/10,500명, 5건), 눈충혈 및 에스지피티 (SGPT) 증가 각 0.04% (4명/10,500명, 4건), 가슴압력감, 구토, 구역, 알칼리인산분해효소증가, 피로 각 0.03% (3명/10,500명, 3건), 목경직, 요도통증, 콩팥통증, 구내건조, 가슴쓰림, 위장관질환, 졸음, 백혈구수증가, 혈소판감소증, 불안, 수면장애, 혈색소감소 각 0.02% (2명/10,500명, 2건), 눈통증 0.01%(1명/10,500명, 2건), 흉통, 관절통, 과다호흡, 눈출혈, 눈꺼풀 부기, 결막출혈, 눈마름증, 복부경련, 빌리루빈증가, 사정장애, 바깥생식기관 통증, 홍반, 가려움, 음경장애, 홍조, 다음증, 심근경색증, 귀울림, 비출혈, 코마름, 크레아티닌 혈중 증가, 딸꾹질, 무력증, 복부불쾌, 복통, 알레르기반응, 얼굴부종, 열, 에스지오티(SGOT)증가, 혈색소증가가 각 0.01% (1명/10,500명, 1건)의 순으로 조사되었다.
– 중대한 약물유해반응은 안면홍조 0.02%(2명/10,500명, 2건) 이었다.
– 예상하지 못한 약물유해반응 발현율은 0.31%(33명/10,500명, 37건)으로, 혈액요소질소증가 0.06%(6명/10,500명, 6건), 알칼리인산 분해효소증가 0.03% (3명/10,500명, 3건), 목경직, 백혈구수증가, 불안, 요도통증, 콩팥통증, 혈색소감소, 혈소판감소증이 각 0.02%(2명/10,500명, 2건), 과다호흡, 결막출혈, 눈마름증, 눈출혈, 다음증, 딸꾹질, 바깥생식기관통증, 사정장애, 열, 음경장애, 코마름, 크레아티닌 혈중 증가, 혈색소증가, 홍반이 각 0.01%(1명/10,500명, 1건)으로 조사되었다.
5) 국내 자발적 부작용 보고 결과, 부작용이 보고된 다른 의약품에서 발생한 부작용과 비교하여 통계적으로 유의하게 발생한 유해사례 중 예상하지 못한 유해사례는 다음과 같이 나타났다. 다만, 이 약과의 인과관계는 확인되지 않았다.
– 효과없음 (medicine ineffective)
– 전신 : 오한
– 근골격계 : 골격통증
5. 일반적 주의
1) 환자의 눈(한쪽 또는 양쪽 눈)에 갑작스런 시력 상실이 발생하는 경우, 의사는 이 약을 포함한 PDE5 저해제의 사용을 중지할 것을 환자에게 권고하고 의학적인 주의를 기울여야 한다. 이러한 증상은 영구적인 시력 상실을 포함한 시력 감퇴의 원인이 될 수 있는, 드물게 나타나는 질병인 비동맥전방허혈성시신경증(Non-arteritic anterior ischemic optic neuropathy, NAION)의 징후가 될 수 있으며, 이는 시판 후 조사에서 드물게 보고되었고 PDE5 저해제의 투여와 잠정적인 상관성이 있는 것으로 나타났다. 발표된 문헌에 따르면, 비동맥전방허혈성시신경증의 연간 발생율은 50세 이상의 남성에서 100,000명당 2.5-11.8건이다.
한 증례-교차 관찰 연구에서 NAION 발현 직전에 (5 반감기 이내) PED5 저해제 계열을 사용한 경우의 NAION 위험이 그보다 앞선 기간에 PDE5 저해제를 사용한 경우와 비교하여 평가되었다. 연구 결과 NAION 위험이 약 2배 증가하는 것으로 제시되었으며, 위험 추정치는 2.15 (95% CI 1.06, 4.34)였다. 유사한 시험에서도 일관된 결과가 보고되었으며, 위험 추정치가 2.27 (95% CI 0.99, 5.20)이었다. 이들 시험에서는 “밀집된” 시신경 유두의 존재와 같은 NAION의 기타 위험 요인이 NAION 발생에 기여했을 수 있다. 시판 후의 드문 보고 또는 관찰 연구에서 PDE5 저해제 사용과 NAION의 관련성이 PDE5 저해제 사용과 NAION 사이의 인과관계를 뒷받침하지는 않는다(4. 이상반응 참조).
의사는 기존의 비동맥전방허혈성시신경증 위험 인자가 있는 환자들이 PDE5 저해제 투여에 의해 유해한 영향을 받을 수 있는지 여부를 고려해야 한다. 이미 비동맥전방허혈성시신경증을 경험한 적이 있는 사람의 경우, 비동맥전방허혈성시신경증 재발의 위험이 더 높다. 따라서, 이런 환자들에서 이 약을 포함한 PDE5 저해제를 투여하는 경우 주의를 기울여야 하며, 기대되는 유익성이 위험을 상회하는 경우에만 투여해야 한다(4. 이상반응 항 참조).
2) 이 약은 출혈이상 또는 활동성 소화성궤양 환자에게 투여한 경험이 없다. 비록 이 약이 건강한 지원자에게서는 출혈시간을 연장시키지 않는 것으로 나타났지만, 출혈이상 또는 활동성 소화성궤양 환자에게는 유익성/위험성을 평가한 후 신중히 투여한다.
3) 이 약과 알코올은 모두 경미한 혈관 확장작용이 있으므로 병용투여시 혈압 강하작용이 증강될 수 있다. 의사는 많은 양의 알코올과 이 약의 병용투여시 심박수 증가, 혈압 감소, 어지럼증, 두통 등 기립성 증후 및 증상이 나타날 수 있음을 환자에게 알려주어야 한다.
4) 갑작스런 청력감퇴 또는 난청(이명과 현기증이 동반될 수 있음)이 발생하는 경우, 의사는 이 약을 포함한 PDE5 저해제의 사용을 중지할 것을 환자에게 권고하고 즉시 의학적인 주의를 기울여야 한다(‘이상반응’ 및 ‘시판 후 조사’ 참조).
5) 타다라필 5mg 1일 1회 용법은 2년 6개월 이상의 임상사용경험은 없다(타다라필 5mg 단일제에 한함).
6. 상호작용
아래에서 보는 바와 같이, 타다라필 10mg 및/또는 20mg에 대하여 많은 상호작용 연구가 실시되었다. 타다라필 10mg 용량만을 사용한 상호작용 연구들에 관해서는 고용량 투여시 임상적으로 유의한 상호작용이 나타날 가능성을 완전히 배제할 수 없다.
1) 타다라필에 대한 다른 약물들의 작용
– 타다라필은 주로 CYP3A4에 의하여 대사된다. CYP3A4의 선택적인 저해제인 케토코나졸(1일 200mg)은 타다라필 단독 투여시의 AUC, Cmax 값에 비해, 타다라필(10mg)의 AUC를 2배, Cmax를 15 % 증가시켰고, 케토코나졸(1일 400mg)은 타다라필(20mg)의 AUC를 4배, Cmax를 22 % 증가시켰다.
– CYP3A4, CYP2C9, CYP2C19, CYP2D6을 저해하는 protease inhibitor인 ritonavir(1일 2회 200mg 투여)는 Cmax의 변화없이 타다라필(20mg)의 AUC를 2배 증가시켰다.
– 특이적인 상호작용이 연구되지는 않았지만, saquinavir 등의 다른 protease inhibitors, 그리고 erythromycin, clarithromycin, itraconazole 및 grapefruit juice와 같은 다른 CYP3A4 inhibitors는 타다라필의 혈장 농도를 증가시킬 것으로 예상되므로 주의하여 병용 투여 되어야 한다. 그 결과로서 4항에 열거한 이상반응의 발생빈도가 증가될 수 있다.
– CYP3A4 유도물질인 리팜피신(rifampicin)은, 타다라필 단독투여시(10mg 용량)의 AUC 값에 비해, 타다라필의 AUC를 88% 감소시켰다. 이는 타다라필의 효능을 감소시킬 수 있지만, 그 감소 정도는 알려지지 않았다. 페노바르비탈(phenobarbital), 페니토인(phenytoin) 및 카르바마제핀(carbamazepine)과 같이 다른 CYP3A4 유도물질과의 병용 투여 역시 타다라필의 혈장 농도를 감소시킬 수 있음을 예상할 수 있다.
– 타다라필의 분포(disposition)에서 수송자(transporters)의 역할(예를 들면 p-glycoprotein)은 알려져 있지 않다. 따라서, 수송자(transporters)의 저해에 의한 약물상호 작용 가능성도 있다.
– 이 약과 제산제 (수산화마그네슘/수산화알루미늄)의 병용투여시 이 약의 노출(AUC)에는 변화 없이 이 약의 흡수율이 명백히 감소되었다.
2) 다른 약물들에 대한 타다라필의 작용
– 임상시험에서, 타다라필(5mg, 10mg과 20mg)은 질산염(nitrates)의 혈압저하 작용을 증가시키는 것으로 나타났다. 따라서, 어떠한 형태의 유기 질산염(organic nitrate) 제제라도 정기적 및/또는 간헐적으로 복용하는 환자에게는 이 약의 투여가 금기이다[1. 경고 및 2. 다음 환자에는 투여하지 말 것 항 참조]. 임상시험 결과에 따르면, 150명의 환자가 타다라필을 매일 20mg씩 7일 동안 투여하고 0.4mg nitroglycerin 설하정을 다양한 시간대에 투여하였을 때, 이러한 상호작용은 24시간 이상 지속되었고 타다라필을 마지막으로 투여한 후 48시간이 지났을 때 더 이상 나타나지 않았다. 따라서, 이 약을 투여(타다라필 2.5mg-20mg)한 환자가 생명에 위협을 받는 상황에 처하여 질산염의 투여가 의학적으로 반드시 필요한 경우에는 이 약을 마지막으로 투여한 후 최소한 48시간이 지난 후에야 질산염의 투여를 고려할 수 있다. 그러한 상황에서 질산염을 투여할 때는 적절한 혈액 역학적 모니터링(haemodynamic monitoring)과 함께 의사의 세심한 감독이 수반되어야 한다.
– 타다라필은 CYP450 isoforms에 의하여 대사되는 약물의 청소율(clearance)을 임상적으로 유의하게 저해하거나 유도할 것으로 예상되지 않는다. 임상시험 결과 타다라필이 CYP3A4, CYP1A2, CYP2D6, CYP2E1, CYP2C9 및 CYP2C19를 포함하는 CYP450 isoforms을 저해하거나 유도하지 않는다는 것이 확인되었다.
– 타다라필(10mg, 20mg)은 S-와파린 또는 R-와파린(CYP2C9 기질)에 대한 노출(AUC)에 있어서 임상적으로 유의한 작용을 나타내지 않았으며, 타다라필은 와파린(warfarin)에 의해 유도된 프로트롬빈 시간(prothrombin time)의 변화에도 영향을 미치지 않았다.
– 타다라필(10mg, 20mg)은 아세틸살리실산(acetyl salicylic acid)에 의한 출혈 시간을 증가시키지 않았다.
– 임상 약리학 시험에서 타다라필이 항고혈압제의 혈압저하 작용을 증가시킬 가능성에 대하여 조사하였다. 칼슘통로차단제(amlodipine), 안지오텐신 전환효소(ACE) 저해제(enalapril), 베타-아드레날린성 수용체 차단제(metoprolol), 치아짓계 이뇨제(bendrofluazide), 안지오텐신 II 수용체 차단제(다양한 형태 및 용량, 단독 또는 치아짓계 이뇨제(thiazides), 칼슘통로차단제, 베타-차단제, 및/또는 알파-차단제와의 병용)를 포함하여, 주요 항고혈압제군이 연구되었다. 타다라필(20mg 용량이 적용된 안지오텐신 II 수용체 차단제 및 amlodipine에 대한 연구들을 제외한 10mg)은 이 계열의 어떠한 약물과도 임상적으로 유의한 상호작용이 없었다.
– 다른 임상약리 시험에서 타다라필 20mg을 항고혈압 치료제 4종류까지와 함께 병용투여하여 연구하였다. 여러 항고혈압 치료제를 투여한 환자에서 ambulatory blood pressure의 변화는 혈압조절 정도와 관련이 있는 것으로 나타났다. 이와 관련하여, 혈압조절이 잘 되지 않는 환자에서는, 비록 이러한 혈압감소가 대부분의 환자에서 저혈압 증상과 관련이 있지는 않았지만 그 감소가 더 컸다. 혈압조절이 잘 되고 있는 환자에서는 혈압감소가 적었고 건강한 사람에서 나타나는 것과 비슷하였다.
– 항고혈압 약제(antihypertensive medications)를 병용하는 환자들에서, 타다라필 20mg이 혈압 감소를 일으킬 수 있으며, 이것은(알파차단제는 제외, 아래 참조) 일반적으로 중요치 않으며 임상적으로 유의하지 않을 것으로 판단된다. 제 3상 임상시험 자료의 분석 결과, 항고혈압 약제를 이 약과 병용한 환자군과 항고혈압 약제 없이 이 약을 복용한 환자군 간에 이상반응에는 차이가 없었다. 그러나, 항고혈압 약제를 병용하는 경우 혈압의 감소 가능성에 관해서 환자들에게 적절한 임상적인 권고(appropriate clinical advice)를 하여야 한다.
– 알파(1)-adrenergic receptor blocker인 독사조신(1일 4mg 또는 8mg)과 타다라필(5mg 1일 1회용법 또는 20mg 단회투여)을 병용한 환자에서 독사조신의 혈압저하 효과가 유의한 정도로 증가하였다. 이 효과는 투여 후 12 시간까지 여전히 나타났으며 기절을 포함한 증상이 나타날 수 있다. 따라서, 타다라필과 독사조신과의 병용은 권장되지 않는다.
– 한정된 인원의 건강한 지원자를 대상으로 한 상호작용 연구에서, 타다라필(10mg, 20mg)과 알파조신(alfuzosin) 혹은 선택적인 알파(1A)-adrenergic receptor 차단제인 탐스로신(tamsulosin)의 병용투여시 임상적으로 유의한 혈압변화가 보고되지 않았다. 그러나, 알파 차단제로 치료 받고 있는 환자 및 특히 고령자의 경우는 타다라필 사용시 주의를 기울여야 한다. 치료는 최소용량으로 시작해서 점진적으로 조절되어야 한다.
– 알코올 농도(평균 최대 혈중 농도 0.08%)가 타다라필(10mg 또는 20mg)의 병용 투여에 의해 영향 받지 않았다. 또한, 알코올을 병용 투여한 후 3시간째에 타다라필 농도의 변화가 나타나지 않았다.
알코올은 그 흡수효과를 최대화 하기위한 방법(하룻밤동안 단식하고 알코올 투여 후 2시간까지 음식을 주지 않음)으로 투여되었다. 타다라필(20mg)과 알코올을 함께 투여하는 경우 타다라필은 고용량의 알코올(0.7g/kg 또는 80kg 남성에서 40% 알코올[보드카] 약 180ml)에 의하여 유도되는 평균 혈압감소를 증가시키지 않았지만, 일부 환자에서는 체위성 현기증과 기립성 저혈압이 관찰되었다. 타다라필을 저용량의 알코올(0.6g/kg)과 투여하였을 때, 저혈압은 관찰되지 않았고 현기증은 알코올 단독으로 투여하였을 때와 유사한 빈도로 나타났다. 인식기능에 대한 알코올의 작용은 타다라필(10mg)에 의하여 증가되지 않았다.
– 타다라필은 ethinylestradiol의 경구 생체이용률(bioavailability)을 증가시키는 것으로 나타났다. 임상적인 중요성은 불확실하지만 terbutaline의 경구 투여시 유사한 증가가 예상될 수도 있다.
– 임상 약리학 연구에서 타다라필 10mg을 테오필린(theophylline(a non-selective phosphodiesterase inhibitor))과 함께 투여했을 때 약동학적 상호작용이 없었다. 유일한 약력학적 작용은 약간의 심박수(3.5 bpm) 증가였다. 동 연구에서 이 작용은 중요하지 않고 임상적인 유의성도 없었지만, 이러한 약물들을 병용 투여할 경우에는 이러한 작용을 고려하여야 한다.
– 항당뇨병 약제들과의 특이적인 상호작용 연구가 수행되지 않았다.
7. 임부ㆍ수유부 및 소아에 대한 투여
1) 이 약은 여성, 신생아 및 소아에게 사용할 수 없다.
2) 랫트를 대상으로 한 동물실험에서 타다라필 및/또는 그 대사체는 태반을 통과하였고 혈중검출농도에 비해 약 2.4 배 높은 농도로 유즙으로 분비되었다. 임신 여성에서 타다라필의 사용에 대하여 연구된 바 없다.
3) 1,000mg/kg/일까지 투여한 랫트나 마우스에서 최기형성(teratogenicity), 배자독성(embryotoxicity) 또는 태아독성(fetotoxicity)의 증거가 없었다.
8. 운전 및 기계 사용능에 대한 영향
이 약이 운전 및 또는 기계 사용능에 미치는 영향은 전혀 없거나 무시해도 좋을 것으로 예상 된다. 이러한 잠재적인 영향을 평가하기 위한 특이적인 연구가 실시되지 않았다. 임상시험 결과 위약과 타다라필 시험군에서 어지럼증(dizziness)의 발현 빈도가 유사하지만, 환자는 운전이나 기계 조작 전에 본인이 이 약에 어떻게 반응하는지 인식하고 있어야 한다.
9. 과량투여시의 처치
1) 건강한 피험자들에게 최고 500mg까지의 용량을 1회 투여한 적이 있고, 환자들에게 최고 100mg까지의 1일 투여량을 여러 번 투여한 적이 있다. 이상반응은 저용량에서 발견된 것과 유사하였다.
2) 과량투여의 경우에는 필요시 표준 보조요법(standard supportive measures)을 실시한다. 혈액투석은 타다라필 배설에 거의 영향을 미치지 않는다.
10. 보관 및 취급상의 주의사항
1) 어린이의 눈에 띄지 않고, 손이 닿지 않는 곳에 보관할 것
2) 다른 용기에 바꾸어 넣는 것은 사고원인이 되거나 품질 유지면에서 바람직하지 않으므로 원래 포장 상태로 보관할 것
11. 의약품동등성시험 정보
12. 기타
1) 약력학적 특성
타다라필은 cyclic guanosine monophosphate(cGMP)-특이적인 phosphodiesterase type 5(PDE5)에 대하여 선택적, 가역적 저해제이다. 성적 자극(sexual stimulation)이 국소적으로 질소산화물(nitric oxide)의 방출을 일으킬 때, 타다라필에 의한 PDE5의 억제가 해면체(corpus cavernosum)에서 cGMP의 수치를 증가시킨다. 이것은 평활근 이완(smooth muscle relaxation)과 음경 조직으로의 혈액 유입을 가져옴으로써 발기(erection)를 일으킨다. 타다라필은 성적 자극이 없을 때에는 효력이 없다.
In vitro 시험 결과, 타다라필은 PDE5의 선택적인 저해제이다. PDE5는 해면체 평활근, 맥관 및 내장 평활근(vascular and visceral smooth muscle), 골격근, 혈소판, 신장, 폐 및 소뇌(cerebellum) 에서 발견되는 효소이다. 타다라필의 효과는 다른 phosphodiesterases보다 PDE5에 대하여 더 큰 효능이 있다. 타다라필은 심장, 뇌, 혈관, 간과 다른 기관에서 발견되는 효소인 PDE1, PDE2, PDE4 보다는 PDE5에 대하여 10,000배를 초과하는 더 큰 효능이 있다. PDE3가 심 수축성(cardiac contractility)에 관여하는 효소이므로, PDE3보다 PDE5에 대한 이러한 선택성은 중요하다. 또한 타다라필은, 망막(retina)에서 발견되는 효소이자 phototransduction을 담당하는 PDE6보다 PDE5에 대하여 약 700배 더 효능이 있다. 타다라필은 또한 PDE7~PDE10보다 PDE5에 대하여 10,000배를 초과하는 더 큰 효능이 있다.
이 약(필요시 투여용량)의 반응기간을 명확히 하기 위하여 편안하게 갖취진 시설(at-home setting)에서 1,054명의 환자를 대상으로 3개의 임상시험을 실시하였다. 이 약은 발기부전을 통계적으로 유의하게 개선시켰으며, 위약과 비교하여 투여 16분 후부터 성공적인 관계를 위한 발기상태가 유지될 뿐 아니라 투여한 후 환자들이 36시간까지 성공적인 성관계를 가질 수 있게 됨이 입증되었다.
건강한 피험자들에게 이 약을 투여했을 때, 앙와위(supine) 심장수축기(systolic) 및 이완기(diastolic) 혈압(각각 1.6/0.8 mmHg의 평균 최대 감소), 서있을 때 심장수축기 및 이완기혈압(각각 0.2/4.6 mmHg의 평균 최대 감소)의 측면에서 위약과 비교하여 유의한 차이가 없었으며 심박수에 있어서도 유의한 차이가 없었다.
시각에 대한 타다라필의 작용을 평가하기 위한 연구에서, Farnsworth-Munsell 100-hue test을 사용했을 때, 색 식별(청색/녹색)의 장애가 검출되지 않았다. 이러한 결과는 PDE5와 비교할 때 PDE6에 대한 타다라필의 낮은 친화력과 일치한다. 모든 임상 시험에 걸쳐, color vision의 변화에 대한 보고는 드물었다(〈0.1 %).
이 약의 정자형성(spermatogenesis)에 대한 잠재적인 영향을 평가하기 위해, 본 약물 10mg을 6개월 간 매일 복용하거나, 20mg을 각각 6개월 또는 9개월 간 매일 복용한 남성들에서 3 가지 임상연구들이 실시되었다. 이 중 2 개의 연구에서 타다라필의 치료와 관련하여 임상적 타당성은 없어 보이는 정자 숫자와 농도의 감소가 관찰되었다. 정자 운동성, 형태, 난포자극호르몬(follicle stimulating hormone) 의 다른 척도들의 변화는 관찰되지 않았다[1.경고 항 참조].
다양한 심각도(경증, 중등도, 중증)와 병인의 853명의 발기부전 환자(여러 인종, 연령범위 : 21-82세)를 대상으로 실시한 3개의 임상시험에서, 타다라필 2.5, 5, 10mg의 1일 1회 요법이 처음으로 평가되었다. 이들 중, 일반 집단을 대상으로 한 2개의 임상시험에서 1차적인 효능을 평가한 결과, 성교시도 성공률에서 위약의 31%, 37%와 비교했을 때, 이 약 5mg은 57%, 67%, 2.5mg은 50%로 나타난 것으로 보고되었다. 또한, 당뇨를 동반한 발기부전 환자를 대상으로 한 나머지 1개의 임상시험에서는 위약의 28%와 비교했을 때, 이 약 5mg은 41%, 2.5mg은 46%로 나타난 것으로 보고되었다. 이 3개의 임상 시험에 참여했던 환자 대부분은 과거에 필요에 따른 PDE5 저해제 투여 시 반응한 경험이 있었다.
이후, PDE5 저해제를 투여한 경험이 없는 환자 217명을 대상으로 하여 타다라필 5mg 1일 l회 투여군과 위약군에 무작위 배정하여 시험한 결과, 피험자 당 평균 성교시도 성공률은 타다라필군과 위약군에서 각각 69%와 52%로 나타났다.
척수 손상된 발기부전 환자 186명에게 12주간 실시한 시험에서(타다라필 투여 142명, 위약 투여 44명) 타다라필 10mg 또는 20mg로 치료된 환자에서(flexible dose, on demand), 위약으로 인한 17%와 비교했을 때 이 약을 투여한 환자의 48%가 각 개인의 발기 기능이 평균으로 상당히 향상되었다.
2) 약동학적 특성
① 흡수
타다라필은 경구 투여 후 신속히 흡수되며 관찰된 평균 최대 혈장 농도(Cmax)는 투여 후 중간값으로 2시간에 도달하였다. 경구 투여 후 타다라필의 절대 생체이용률은 결정되지 않았다.
타다라필의 흡수율과 흡수정도는 식사에 의하여 영향 받지 않으므로 이 약은 식사와 함께 또는 식사를 하지 않고 복용할 수 있다. 복용 시간(아침 대 저녁)은 흡수율과 흡수정도에 대하여 임상적으로 연관성 있는 작용이 없었다.
② 분포
평균 분포용적이 약 63 L이며, 이는 타다라필이 조직에 분포됨을 나타낸다. 치료 농도에서 혈장에 있는 타다라필의 94%가 단백질에 결합한다. 단백질 결합은 신 기능 장애에 의하여 영향 받지 않는다.
투여 용량의 0.0005% 미만이 건강한 피험자의 정액(semen)에서 발견되었다.
③ 생체전환(Biotransformation)
타다라필은 사이토크롬 P450(CYP) 3A4 isoform에 의하여 주로 대사 된다. 주요 순환 대사산물은 메틸카테콜 글루쿠로나이드(methylcatechol glucuronide)이다. 이 대사산물은 PDE5에 대하여 타다라필보다 최소 13,000배 더 적은 효능이 있다. 따라서, 관찰한 대사산물 농도에서 임상적으로 활성이 있다고 예상되지 않는다.
④ 배설
건강한 피험자들에서 타다라필의 평균 경구 청소율(clearance)은 2.5 L/시간이고 평균 반감기는 17.5 시간이다. 타다라필은 불활성화 대사산물로 유력하게 배설되며, 주로 대변(투여량의 약 61 %)과 뇨에서는 더 소량(투여량의 약 36 %)이 배설된다.
⑤ 선형성/비-선형성(linearity/non-linearity)
건강한 피험자들에서 타다라필의 약동학은 시간과 투여량에 대하여 선형적(linear)이다.
2.5-20mg의 투여량 범위에서, 노출(exposure ; AUC)이 투여량과 비례하여 증가한다. 1일 1회 투여한 경우 5일 이내에 steady-state plasma concentrations에 도달한다.
발기 부전 환자들에서 population approach로 결정된 약동학이 발기 부전이 없는 피험자들에서의 약동학과 유사하다.
<특수 집단>
① 고령자
건강한 고령 피험자들(65세 이상)은 19세~45세의 건강한 피험자에 비하여, 타다라필의 경구 청소율이 더 낮았으며 이는 25% 더 높은 노출(exposure ; AUC)을 가져 왔다. 이러한 연령의 효과는 임상적으로 유의하지 않으며 용량 조절(dose adjustment)을 정당화하지 않는다.
② 신기능 부전증
경증(크레아티닌 청소율 51-80mL/분) 또는 중등도(크레아티닌 청소율 31-50mL/분)의 신장애를 가진 피험자 및 투석을 하는 말기 신부전 피험자들에게 타다라필 1회 용량(5-20mg)을 사용한 임상약리 연구에서 타다라필의 노출(AUC)은 약 두배였다. 혈액투석 환자들에서, Cmax는 건강한 피험자들보다 41% 높게 관찰되었다. 혈액투석은 타다라필 배설에 거의 영향을 미치지 않는다.
③ 간기능 부전증
10mg 복용량이 투여 되었을 때 경증 또는 중등도의 간 장애(Child-Pugh Class A 및 B)가 있는 피험자들에서 타다라필의 노출(exposure ; AUC)이 건강한 피험자들에서의 노출(exposure)과 필적하였다. 중증 간기능부전 환자(Child-Pugh Class C)에서 이 약의 안전성에 대한 임상자료는 제한적이므로 처방하는 경우, 의사는 신중하게 개개의 유익성/위험성(benefit/risk) 을 평가하여야 한다.
간 장애가 있는 환자들에서 타다라필 10mg보다 더 고용량의 투여에 대하여 이용 가능한 자료가 없다.
간 장애가 있는 환자들에게 타다라필 1일 1회 투여 용량에 대한 이용 가능한 자료가 없으므로 처방하는 경우, 의사는 신중하게 개개의 유익성/위험성(benefit/risk) 을 평가하여야 한다.
④ 당뇨병 환자
당뇨병 환자들에서의 타다라필의 노출(exposure ; AUC)이 건강한 피험자들에서의 AUC 값 보다 약 19 % 낮았다. 노출(exposure)에서의 이러한 차이는 용량 조절을 정당화하지 않는다.
3) 전임상 안전성 자료
안전성 약리학, 유전 독성, 발암 가능성, 및 생식 독성에 대한 고식적인 연구들을 기초로 한 전임상 자료는 인체에 특별한 위험을 나타내지 않았다.
1,000mg/kg/일까지 투여한 랫트나 마우스에서 최기형성(teratogenicity), 배자독성(embryotoxicity) 또는 태아독성(fetotoxicity)의 증거가 없었다. 랫트의 산전 및 생후 발육 연구(pre- and postnatal developmental study)에서, no observed effect dose가 30mg/kg/일이었다. 임신 랫트에서 이 용량에서의 calculated free drug에 대한 AUC가 20mg 용량에서 인체 AUC의 약 18배였다.
암수 랫트에서 수정능력(fertility)의 장애가 없었다. 타다라필을 6~12 개월 간 매일 25mg/kg/일 및 그 이상의 용량으로 개에 투여했을 때, 몇몇 개에서 정자형성의 감소를 가져오는 정세관상피(seminiferous tubular epithelium)의 퇴행이 있었다[1. 경고 및 11.1) 약력학적 특성 항 참조].
11. 의약품동등성시험 정보
가. 시험약 고든정20mg(타다라필)[㈜씨티씨바이오]과 대조약 시알리스정20밀리그램(타다라필)[한국릴리(유)]을 2×2 교차시험으로 각 1정씩 건강한 성인에게 공복 시 단회 경구투여하여 30명의 혈중 타다라필을 측정한 결과, 비교평가항목치(AUCt, Cmax)를 로그변환하여 통계처리하였을 때, 평균치 차의 90% 신뢰구간이 log 0.8에서 log 1.25 이내로서 생물학적으로 동등함을 입증하였다.
|
구분 |
비교평가항목 |
참고평가항목 |
|||
|
AUC0-72hr (ng·hr/mL) |
Cmax (ng/mL) |
Tmax(hr) |
t1/2(hr) |
||
|
대조약 |
시알리스정20밀리그램 (타다라필) [한국릴리(유)] |
7237±1897 |
326.8±66.8 |
1.50[0.50~5.00] |
19.26±5.54 |
|
시험약 |
고든정20mg (타다라필) [㈜씨티씨바이오] |
7261±2184 |
324.4±75.8 |
2.00[0.50~4.00] |
19.10±5.91 |
|
90% 신뢰구간* (기준 : log 0.8 ~ log 1.25) |
log 0.9384~ 1.0423 |
log 0.9280~ 1.0477 |
– |
– |
|
|
(AUCt, Cmax, t1/2 ; 평균값±표준편차, Tmax ; 중앙값(범위), n=30) AUCt : 투약시간부터 최종혈중농도 정량시간 t까지의 혈중농도-시간곡선하면적 Cmax : 최고혈중농도 Tmax : 최고혈중농도 도달시간 t1/2 : 말단 소실 반감기 * 비교평가항목치를 로그변환한 평균치 차의 90%신뢰구간 |
|||||
나. 의약품동등성시험기준 제7조제2항에 따라, 시험약 고든정10mg, 5mg(타다라필)[㈜씨티씨바이오]은 대조약 고든정20mg(타다라필)[㈜씨티씨바이오]과의 비교용출시험자료를 제출하였으며, 대조약과 용출양상이 동등하였다. 이에 따라 해당 자료로서 생물학적동등성을 입증하였다.
고든정10mg의 제조/수입사 정보
고든정10mg의 제조/수입사 정보는 다음과 같습니다.
| 회사명 | 씨티씨바이오 CTCBIO |
| 주소 | (138-130) 서울 송파구 오금동 93 |
| 전화번호 | 070-4033-0200 |
| 팩스번호 | 02-449-6966 |
| 홈페이지 | http://www.ctcbio.com/ |
위 내용들은 ‘약학정보원’, ‘식품의약품안전처’ 에 제공된 정보를 기반으로 작성되었습니다.

